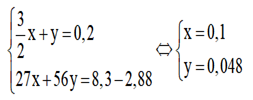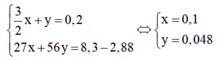Câu 4. (2,5đ)
Cho 17,7 gam hỗn hợp bột gồm kim loại sắt và kẽm vào dung dịch CuSO4 dư. Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn có khối lượng 19,2 gam . Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu .
Câu 5. (1,0đ)
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết vị trí của A trong bảng hệ thống tuần hoàn và tính chất cơ bản của A ?
Câu 6. (2,0đ)
Cho bột Al tác dụng hết với dung dịch NaOH dư, đun nóng giải phóng ra khí B không màu, không mùi. Cho 1 dòng khí CO2 đi qua dung dịch thấy kết tủa trắng xuất hiện. Thêm dung dịch HCl vào khuấy đều lại thấy kết tủa đó tan hết. Viết các PTHH của các phản ứng đã xảy ra.